اوربیتال اتمی
از نظر لغوی اوربیتال به معنای خانه الکترون میباشد و ناحیهای است که احتمال یافتن الکترون در آن زیاد است. معادله شرودینگر پایه مکانیک موجی است. این معادله بر حسب یک تابع موجی سای برای الکترون نوشته میشود. از حل معادله شرودینگر اتم هیدروژن یک سلسله جواب به عنوان تابع موج بدست میآید. تابع موج ناحیهای در اطراف هسته را نشان میدهد که در آن ناحیه، احتمال یافتن الکترون وجود دارد.
تابع موجی یک الکترون، آنچه را که اوربیتال نامیده میشود، توصیف میکند
اوربیتال محدودهای از فضای اطراف هسته میباشد که احتمال یافتن الکترون در آن وجود دارد. این احتمال در نزدیکی هسته بیش ترین مقدار را دارد. ولی برای تمام نقاطی از فضا که فاصله معینی از هسته دارند، احتمال معینی وجود دارد. هر اوربیتال میتواند حداکثر دو الکترون را در خود جای دهد. دو الکترونی که در یک اوربیتال جای میگیرند، دارای اسپین مخالف هستند.
براساس اصل طرد پاولی در یک اتم هیچ دو الکترونی را نمیتوان یافت که تمام چهار عدد کوانتومی آنها یکسان باشد.
تفسیر مکانیکی اوربیتال
شدت هر موج با مجذور دامنه آن متناسب است. تابع موجی (سای) ، تابع دامنه است. مجذور دامنه یا مجذور تابع موجی برای یک حجم کوچک در هر موقعیتی از فضا با چگالی بار الکترونی در آن حجم متناسب است.
میتوان تصور کرد که بار الکترونی به سبب حرکت سریع الکترون به صورت ابر باردار در فضای دور هسته گسترده شده است. این ابر در برخی نواحی غلیظ تر از برخی نواحی دیگر است. احتمال یافتن الکترون در هر ناحیه معین متناسب با چگالی ابر الکترونی در آن ناحیه است. این احتمال در ناحیهای که ابر الکترونی غلیظ تر باشد، بیشتر خواهد بود.
این تفسیر کوششی برای توصیف مسیر الکترون به عمل نمی آورد، بلکه فقط پیشبینی میکند که احتمال یافتن الکترون در کجا بیشتر است. از نظر مکانیک کوانتومی هیچ محدودیتی برای وجود الکترون در فضا اطراف هسته وجود ندارد. پس بینهایت اوربیتال وجود دارد.
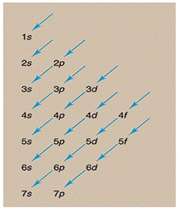
اعداد کوانتومی
مکانیک موجی که نظریه شرودینگر اساس آن میباشد با استفاده از چهار عدد کوانتومی وضعیت الکترون را توصیف میکند. این اعداد عبارتند از :
عدد کوانتومی اصلی
این عدد نشاندهنده ترازهای انرژی است که الکترونها در آن ترازها به دور هسته گردش میکنند و عدد صحیحی میباشد. این عدد میتواند کلیه مقادیر اعداد صحیح مثبت به جز صفر را قبول کند.
آرنولد زمر فیلد در سال 1916 پیشنهاد کرد که هر مدار بور
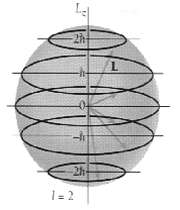
عدد کوانتومی مغناطیسی مداری
تعداد اوربیتالهای یک تراز فرعی را میتوان از این عدد استنتاج کرد که در اثر میدان مغناطیسی هر تراز (L ) به این ترازها شکافته میشود.
عدد کوانتومی مغناطیسی اسپینی
این عدد مشخص کننده حرکت تقدیمی الکترون است و با نشان داده میشود، و میتواند مقادیر-1/2,+1/2 را اختیار کند.
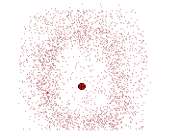
ابر الکترونی و مکان الکترون
در مورد یک الکترون در حالت n=1 اتم هیدروژن، ابر باردار بالاترین چگالی را در نزدیکی هسته دارد و به تدریج که فاصله از هسته افزایش مییابد، رقیقتر میشود. احتمال یافتن الکترون در حجم کوچکی از فضا، در نزدیکی هسته، بیشترین مقدار را دارد و با افزایش فاصله از هسته به سمت صفر میل میکند.
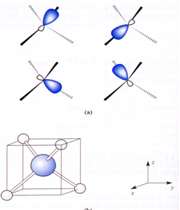
انواع اوربیتال
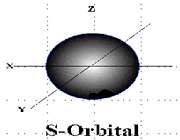
اوربیتال S
اوربیتالهای S دارای تقارن کروی میباشد، تراز n=1 حداکثر دارای دو الکترون است. بنابراین تراز فرعی 1S و 2S و 3S و... هم تقارن کروی دارند، با این تفاوت که اندازه آن ها بزرگتر از اوربیتال 1S میباشد.
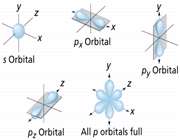
اوربیتال p از سه اوربیتال فرعی تشکیل شده است. هر اوربیتال p به شکل دو کره تغییر شکل یافته است که میتوان آن ها را در امتداد یکی از محورهای سه گانه مختصات ( z,y,x) تصور کرد از این رو اوربیتالهای p را با مشخص میکنند که در سه جهت مختلف قرار گرفتهاند.
اوربیتالهای p از لحاظ انرژی برابرند و در غیاب میدان مغناطیسی نمیتوان تفاوتی بین الکترونهایی که این اوربیتالها را اشغال کردهاند، قایل شد. ولی در بررسیهای طیفی که تحت تأثیر یک میدان مغناطیسی قرار میگیرند. هر اوربیتال به سه خط شکافته میشوند.
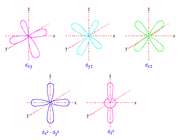
اوربیتالهای d از 5 اوربیتال فرعی تشکیل شدهاند که جهت گیریهای متفاوتی در فضا دارند ولی از لحاظ انرژی باهم همارز هستند.
تعداد الکترون هایی که مقدار انرژی برابر داشته باشند، درجه انحطاط یا چندگانگی نامیده میشوند. حداکثر تعداد الکترون های هر تراز از فرمول
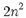
[h=4]مرکز یادگیری سایت تبیان
