پیوند سیگما
اوربیتال S به شکل کره است و مرکز آن در هسته اتم قرار دارد. برای تشکیل پیوند، دو هسته باید به اندازه کافی به یکدیگر نزدیک شوند تا همپوشانی مولکول های اوربیتالهای اتمی صورت پذیرد.
نشان دادن اوربیتالهای اتمی با حروف (P , S , ...) مرسوم است. اوبیتالهای مولکولی نیز با حروف یونانی (
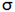
(
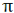
تشکیل پیوند سیگما
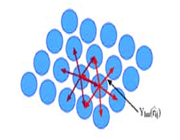
اوربیتالهای مولکولی (H[SUB]2[/SUB])، از همپوشانی دو اوربیتال (S) از دو اتم هیدروژن حاصل شدهاند. اگر همپوشانی طوری بین دو اوربیتال صورت پذیرد که ابر الکترونی بین دو هسته، همدیگر را تقویت کنند، چگالی الکترونی در ناحیه بین دو هسته زیاد خواهد بود و جاذبه دو هسته با بار مثبت نسبت به ابر الکترونی اضافه با بار منفی، مولکول را به هم نگه میدارد و مولکول پایدارتر از اتمهای هیدروژن میشود. اوربیتالهای پیوندی یا اوربیتال مولکولی حاصل، اوربیتالهای سیگما و این پیوندها را پیوندهای سیگما مینامند و با نماد (
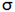
چون دو اوربیتال اتمی با یکدیگر ترکیب شدهاند، باید دو اوربیتال مولکولی به دست آید. اوربیتال مولکولی دیگر، وقتی حاصل می شود که همپوشانی بین دو اروبیتال اتمی طوری صورت پذیرد که ابر الکترونی بین دو هسته، همدیگر را تضعیف کنند.
در این حالت چگالی الکترونی در ناحیه بین دو هسته خیلی کم است.
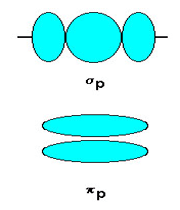
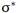
اوربیتالهای سیگما (پیوندی و غیرپیوندی)، به دور محوری که دو هسته را به یکدیگر متصل میکند، تقارن استوانهای دارند و چرخش مولکول دور این محور، تغییر قابل مشاهدهای در شکل اوربیتال به وجود نمیآورد.
انرژی اوربیتالهای سیگما
انرژی اوربیتال پیوندی سیگما از انرژی هر یک از اوبیتالهای اتمی که آن را به وجود آوردهاند کمتر است، در حالی که انرژی اوربیتال ضد پیوندی سیگما از انرژی هر یک از اوبیتالهای اتمی که آن را به وجود آوردهاند بالاتر است. وقتی دو اوربیتال اتمی ترکیب میشوند:
اوربیتال مولکولی پیوندی نشان دهنده کاهش انرژی سیستم و اوربیتال مولکولی ضد پیوندی نشان دهنده افزایش انرژی سیستم است
مرتبه پیوند
هر اوربیتال ( اتمی یا مولکولی ) میتواند دو الکترون با اسپین مخالف را در خود جای دهد. در مولکول هیدروژن دو الکترون ( با اسپینهای جفت شده ) اوربیتال (
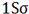
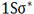
تعداد پیوند یا مرتبه پیوند در هر مولکول عبارت است از نصف الکترون های ضد پیوندی از الکترون های پیوندی است.
مرتبه پیوند برای (H[SUB]2[/SUB]) برابر 1 و برای (He) صفر است.
ترکیب دو اوربیتال (2S)، اوربیتالهای مولکولی (
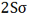
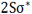
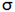
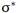
[h=4]مرکز یادگیری سایت تبیان
